一种新型熔融盐燃料电池具有高发电效率。现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2。则下列说法中正确的是 ( )
| A.通CO的一极是电池的正极 |
B.负极发生的电极反应是:O2+2CO2+4e-―→2CO |
C.负极发生的电极反应是:CO+CO -2e-―→2CO2 -2e-―→2CO2 |
| D.正极发生氧化反应 |
下列实验操作所用仪器合理的是()
| A.用25 mL碱式滴定管量取14.80 mL的NaOH溶液 |
| B.用100 mL容量瓶配制50 mL 0.1 mol·L-1NaOH溶液 |
| C.用托盘天平称取25.30 g NaCl |
| D.用50 mL量筒量取4.8 mL H2SO4 |
现有标准状况下一干燥真空烧瓶,质量为201.0 g。当充满Cl2时,质量为203.2 g。若改充满HCl气体时,质量为202.7 g。再用些HCl气体进行喷泉实验后,烧瓶中溶液的物质的量浓度约为()
| A.0.022 mol·L-1 | B.0.045 mol·L-1 |
| C.0.8 mol·L-1 | D.1 mol·L-1 |
体积为1 L的干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此容器倒扣在水中,进入容器中液体的体积是()
| A.0.25 L | B.0.5 L | C.0.75 L | D.1 L |
有五瓶溶液分别是①10 mL 0.60 mol·L-1 NaOH水溶液;②20 mL 0.50 mol·L-1 H2SO4水溶液;③30 mL 0.40 mol·L-1 HCl水溶液;④40 mL 0.30 mol·L-1 CH3COOH水溶液;⑤50 mL 0.20 mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是()
| A.①>②>③>④>⑤ | B.②>①>③>④>⑤ |
| C.②>③>④>①>⑤ | D.⑤>④>③>②>① |
在标准状况下的aL HCl(g)溶于1 000 cm3水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是()
A. mol·L-1 mol·L-1 |
B.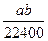 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 |
D. mol·L-1 mol·L-1 |