现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。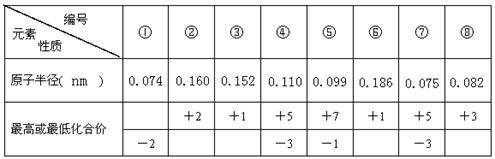
回答下列问题:
(1)①在元素周期表中的位置是(周期、族) ;
(2)比较④和⑦的氢化物的稳定性(用化学式表示) 。
(1)下列实验操作可以达到实验目的的是(填序号,多填扣分)
| A.用铝片与四氧化三铁粉末混合加热进行铝热反应。 |
| B.向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物。 |
| C.用酸性高锰酸钾溶液能鉴别乙烷与乙烯。 |
| D.用饱和Na2CO3溶液除去乙酸乙酯中的少量乙酸。 |
E.利用燃烧的方法可以鉴别出羊毛和棉花织品。
(2)请将下列物质的转化或分离方法的序号填在横线上(每一项只填写一种方法)。
a、蒸馏
b、裂解
c、过滤
d、裂化
e、干馏
f、分馏
g、电解
h、皂化
①把煤转化为焦炉气、煤焦油和焦炭等;
②从原油中分离出汽油、煤油、柴油等;
③将重油转化为汽油;
④将海水淡化;
⑤从海水得到的无水MgCl2中制取金属镁;
⑥用油脂制取肥皂_________________。
可以将氧化还原反应2H2+O2=2H2O设计成原电池。(每空2分)
(1)利用H2、O2、HCl溶液构成燃料电池,则正极的电极反应式为_______________;负极的电极反应式为________________。
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式为_______________,当导线中通过4 mol电子时,需消耗______mol的KOH;将4 mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为_______mol。
现有A、B、C、D四种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)B在周期表中的位置。
(2)写出A的氢化物中原子个数为1:1的物质的电子式:。
(3)写出CD的溶液与氯气反应的离子方程式。
(4)比较A、B两种元素形成的简单离子半径的大小(用离子符号表示):。
①16O和18O
②红磷和白磷
③CH3CH3和CH3CH2CH2CH3
④CH3CH2CH2CH3和CH3CH (CH3)CH3
⑤O2和O3
⑥ 和
和
(1)属于同素异形体的是。
(2)互为同位素的是。
(3)互为同分异构体的是。
(4)属于同系物的是。
(5)属于同种物质的是。
鉴别苯,苯酚溶液,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是;加入该试剂震荡,静置片刻,各种试样出现的相应现象是:
(1)苯。
(2)苯酚。
(3)碘化钾。
(4)硝酸银。
(5)己烯。
(6)四氯化碳。