把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应后取出部分溶液,
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________________。
(8分)银锌电池广泛用于各种电子仪器的电源,它的充放电过程可表示为:
2Ag+Zn(OH)2 Ag2O+Zn+H2O,回答下列有关问题。
Ag2O+Zn+H2O,回答下列有关问题。
(1)电池的放电过程是(填“①”或“②”)。
(2)该电池属于性电池(填“酸”、“碱”或“中”)。
(3)写出充电时阳极的电极反应式:
(4)充电时,电池的正极应接电源的极。
(8分)(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)===2H2O(l) 请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)  2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l)ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是________________。
(3)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l)ΔH1
②2H2(g)+O2(g)===2H2O(g)ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为________。
DEHP是一种增塑剂,被塑料工业广泛应用。DEHP有如下转化关系。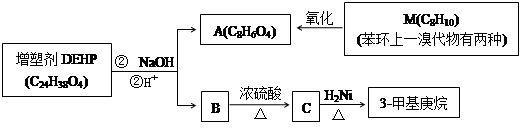
(1)M的结构简式是____________________;
(2)B分子中只有2个甲基,C的主链碳原子数为6,则B的结构简式是__________,化合物C的名称是__________;
(3)写DEHP与NaOH溶液反应的化学方程式______________________________;
(4)F是A的一种同分异构体,具有下列特征:
a.苯的邻位二取代物
b.遇氯化铁溶液显紫色
c.能与碳酸氢钠溶液反应
F与足量碳酸氢钠溶液反应的化学方程式是___________________________________。
肉桂酸异戊酯G(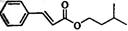 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: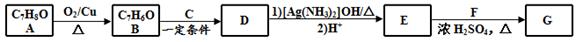
已知以下信息:
① ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为。
(2)B和C反应生成D的化学方程式为。
(3)F中含有官能团的名称为。
(4)E和F反应生成G的化学方程式为,反应类型为。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3︰1的为 (写结构简式)。
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72 L(标准状况下)。有机物A的实验式为____________________。
(2)质谱仪测定有机化合物A的相对分子质量为46,A的核磁共振氢谱如下图所示,则A的结构简式为____________________。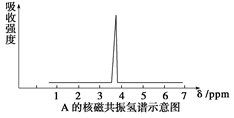
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是____________________________________________。