海带含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: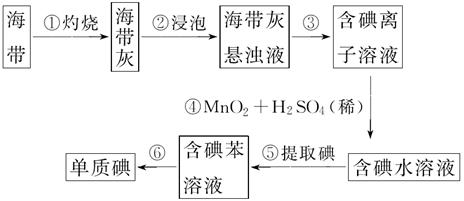
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的仪器是________(从下列仪器中选择所需的仪器,把标号字母填写在空白处)。
| A.烧杯 | B.坩埚 |
| C.表面皿 | D.泥三角 |
E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是________;步骤⑥的目的是从含碘苯溶液中分离出碘和回收苯,该步骤的实验操作名称是________。
(3)步骤④反应的离子方程式是
________________________________________________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
________________________________________________________________________
________________________________________________________________________。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法
________________________________________________________________________
________________________________________________________________________。
I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期。相关信息如下:
| 相关信息 |
|
| X |
单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y |
含Y元素的物质焰色反应为黄色 |
| Z |
同周期元素中原子半径最小 |
| R |
R元素原子的最外层电子数是K层电子数的3倍 |
(1)Z元素在周期表的位置是,Y、Z、R简单离子的半径从大到小的顺序是(用离子符号表示);
 (2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为;
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为,写出乙溶液在空气中变质过程的化学方程式。
II.元素X与氢可形成多种化合物,如丙、丁、戊。
(4)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸。8.6 g丙爆炸分解生成H2和6.72 L(标况下)X2。写出其爆炸的化学方程式;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76 g·L-1,则物质丁的化学式为;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)。
【化学—选修3物质结构与性质】
(1)元素的第一电离能:NO(填“>”或:“<”)
(2)基态Fe2+的电子排布式为。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
则该元素的元素符号是。
(4)NO3-的空间构型(用文字描述),SO42-中S原子的杂化方式为。
(5)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如下图所示,呈现这种变化关系的原因是。
(6)金属铜原子的堆积方式为面心立方最密堆积,铜的原子半径为r nm,则铜晶胞的体积表达式为cm3。
【化学—选修2化学与技术】技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低。生产流程可简要表示如下图:
(1)向沉淀池中要通入CO2和氨气,应先通入________(填化学式)。
(2)沉淀池中发生反应的化学方程式________________,煅烧炉中发生反应的化学方程式是_______________________。
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是,加入细小食盐颗粒的作用是________________。
(4)写出路布兰制碱法的反应原理中属于氧化还原反应的化学方程式,该法与侯德榜制碱法相比的缺点是(写出两点即可)
(5)候氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中的纯度表达式为:。
甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g) CH3OH(g)ΔH=-90.8kJ/mol。
CH3OH(g)ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=,如升高温度,K值将(填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是.
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
上图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是。由起始达到a点所需时间为5min,则H2的反应速率mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。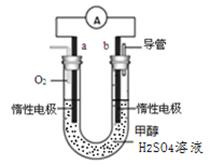
①该电池工作时,正极是极(填“a”或 “b”);
②该电池负极反应的离子方程式为。
海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH) 2 |
9.6 |
11.1 |
①步骤②中需控制pH=9.8,其目的是。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是。
④步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
③NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClOg。