短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素。原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等。下列说法不正确的是
| A.Y、Z、R的简单离子具有相同的电子层结构 |
| B.X2Y属于共价化合物,各原子均满足8电子稳定结构 |
| C.X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性 |
| D.由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
某有机物的结构简式如图所示,关于该物质的叙述错误的是()
A.一个分子中含有12个H原子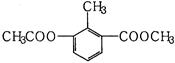 |
| B.苯环上的一氯代物有2种 |
| C.能使酸性KMnO4溶液褪色 |
| D.1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol |
有机物X(C4H6O5)广泛存在于许多水果内,尤以萍果、葡萄、西瓜、山渣内为多,该
化合物具有如下性质:
⑴1molX与足量的金属钠反应产生1.5 mol气体
⑵ X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
⑶ X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是()
| A.X中肯定有碳碳双键 |
| B.X中可能有三个羟基和一个一COOR官能团 |
| C.X中可能有三个羧基 |
| D.X中可能有两个羧基和一个羟基 |
下列各项括号内为杂质,后面为除杂质操作,其中正确的是( )
| A.乙酸乙酯(乙酸),加NaOH溶液、分液 |
| B.福尔马林(乙酸),加Na2CO3溶液、分液 |
| C.溴乙烷(乙醇),加水振荡、分液 |
| D.苯(苯酚),加溴水振荡、过滤 |
某有机物的结构简式如下图,则此有机物可发生的反应类型有( )
①取代反应②加聚反应③消去反应④酯化反应⑤水解反应⑥氧化反应⑦显色反应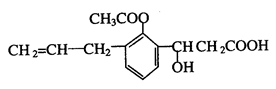
| A.①②④⑥⑦ | B.②③④⑥⑦ | C.①②③④⑤⑥ | D.全部 |
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列各项事实不能说明上述观点的是( )
| A.乙酸分子中羟基上的氢原子较乙醇中羟基上的氢原子更活泼 |
| B.乙炔能发生加成反应,而乙烷不能发生加成反应 |
| C.甲苯的硝化反应较苯更容易 |
| D.苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 |