科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()
| A.N4的熔点比P4高 |
| B.1 mol N4气体转化为N2时要吸收724 kJ能量 |
| C.N4是N2的同系物 |
| D.1 mol N4气体转化为N2时要放出724 kJ能量 |
中和热的数值是57.3kJ/mol。下列酸、碱溶液混合产生的热量等于57.3kJ的是()
| A.1mol/L的稀HCl溶液与1mol/L的稀NaOH溶液 |
| B.1mol/L的稀H2SO4溶液与1mol/L的稀Ba(OH)2溶液 |
| C.1 L 1mol/L的稀HCl溶液与2 L 1mol/L的稀NaOH溶液 |
| D.1 L 1mol/L的稀H2SO4溶液与1 L 1mol/L的稀Ba(OH)2溶液 |
根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是()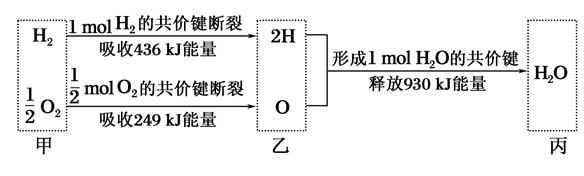
| A.H2O分解为H2与O2时放出热量 |
| B.生成1mol H2O时吸收热量245kJ |
| C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 |
| D.氢气和氧气的总能量小于水的能量 |
下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是()
| A.500mL 2.0mol·L-1 HCl和500mL 2.0mol·L-1 NaOH的反应符合图1,且ΔE=57.3kJ |
| B.500mL 2.0mol·L-1 H2SO4和500mL 2.0mol·L-1 Ba(OH)2的反应符合图2,且ΔE=114.6kJ |
| C.发生图1能量变化的任何反应,一定不需加热即可发生 |
| D.CaO、浓硫酸溶于水时的能量变化符合图1 |
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是()
| A.该反应是吸热反应 |
| B.断裂1mol A—A键和1mol B—B键能放出xkJ的能量 |
| C.断裂2mol A—B键需要吸收ykJ的能量 |
| D.2mol AB的总能量高于1 mol A2和1mol B2的总能量 |
已知1g氢气完全燃烧生成水蒸气时放出121kJ的能量,且氧气中1molO=O键完全断裂时需要吸收496kJ的能量,水蒸气中1mol H—O键形成时放出463kJ的能量,则氢气中1mol H—H键断裂时吸收的能量为()
| A.920kJ | B.557kJ | C.436kJ | D.181kJ |