氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得: SiO2 + C + N2 Si3N4 + CO
Si3N4 + CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是 。
(3)分析反应可推测碳、氮气的氧化性:C N2(填“>”“<”“=”)。
已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;
②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
⑴反应①中元素被还原,反应②中元素被还原。(填元素符号)
⑵当反应①生成2g H2时,消耗H2SO4的质量是g 。
⑶反应②中生成32g SO2气体时,消耗H2SO4的质量是g ,其中有g H2SO4作为氧化剂被还原。
现有①KMnO4②H2③O2④CL2⑤CO⑥AL 六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲:_____ 中,常用的还原剂放入乙:_____中,则:
⑴甲中有;乙中有。(填序号)
⑵由Fe  Fe3O4 ,Fe2O3
Fe3O4 ,Fe2O3 Fe 可知,欲实现I反应过程应从___________(填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从中找物质。
Fe 可知,欲实现I反应过程应从___________(填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从中找物质。
⑶请将4种物质:Fe、Fe2O3、CO、CO2分别填入 下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。(提示:反应物是Fe2O3和3 CO )
下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。(提示:反应物是Fe2O3和3 CO )


 + ="====" +
+ ="====" +
⑷一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:
4X+5O2  4NO+6H2O,则根据质量守恒定律可以推出X的化学式为。
4NO+6H2O,则根据质量守恒定律可以推出X的化学式为。
对于实验室制取O2的反应:2KCLO3 2KCL+3O2↑,其电子转移的方向和数目的标法有以下几种,你认为正确的是(填序号)
2KCL+3O2↑,其电子转移的方向和数目的标法有以下几种,你认为正确的是(填序号)


 该反应中,是氧化剂,是还原剂,MnO2是剂。
该反应中,是氧化剂,是还原剂,MnO2是剂。
(8分)在氧化还原反应中,氧化剂______电子,发生的反应是_________反应;还原剂________电子,发生的反应是____________反应。铁与氯气反应的方程式为,2Fe+3Cl2====2FeCl3生成物中铁是_______价,铁与盐酸的反应式为________,生成物中铁是________价,事实证明,氯气的氧化性比盐酸的氧化性(填“强”“弱”)____________。
下图转化关系中涉及的均是中学化学常见物质(部分产物中的水已略去)。其中A、B、C、D、E、F、G、H在常温下均为气体,且D为红棕色,G为黄绿色。I、J均为白色固体。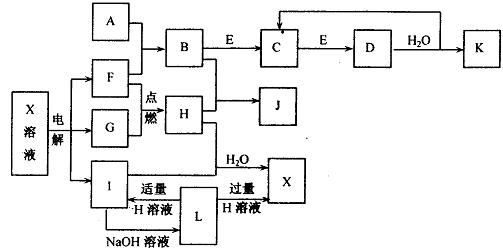
请按要求回答下列问题:
(1)D的化学式为;A的电子式为;
G中所含元素在周期表中的位置是。
(2)写出电解X溶液的阳极反应式。
(3)J溶液的pH(填“<”、“>”或“=”)7;
X溶液pH<7的原因是(用离子方程式表示):
(4)若使1mol B尽可能多地转化为K,则消耗E的物质的量最多为