下列各组元素性质递变的关系错误的是
| A.Li、Be、B原子最外层电子数逐渐增多 |
| B.Li,Na,K的金属性依次增强 |
| C.P、S、C1最高正价依次升高 |
| D.N、0、F氢化物的稳定性依次减弱 |
在下列各反应中,水既不作氧化剂也不作还原剂的氧化还原反应是
| A.2F2+2H2O==4HF+O2 | B.Na2O+H2O==2NaOH |
| C.2Na+2H2O==2NaOH+H2↑ | D.Cl2+H2O==HCl+HclO |
用已准确称量过的氯化钠固体配制1.00 mol·L-1的氯化钠溶液0.5 L,要用到的仪器是
①500 mL容量瓶 ②试管 ③烧瓶 ④胶头滴管 ⑤烧杯
⑥玻璃棒 ⑦托盘天平 ⑧药匙
| A.①④⑤⑥ | B.①②④⑤ | C.①④⑤⑥⑦⑧ | D.全部 |
下列实验操作中正确的是
| A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
| B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 |
| D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 |
.下列实验操作中,不能用于物质分离的是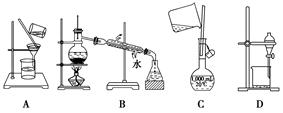
高温下,某反应达平衡,平衡常数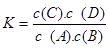 。恒容时,温度升高,B的浓度减小。下列说法正确的是
。恒容时,温度升高,B的浓度减小。下列说法正确的是
①该反应的焓变为正值②恒温恒容下,增大压强,B浓度一定减小
③升高温度,逆反应速率减小④该反应化学方程式为C(g) +D(g)  A(g)+B(g)
A(g)+B(g)
⑤增加A的量,平衡向正反应方向移动⑥加入催化剂,B的转化率提高
| A.①③⑥ | B.①⑤ | C.①④⑤ | D.②⑤ |