反应SO2(g)+NO2(g)  NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是( )
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是( )
| A.平衡左移,容器内压强一定增大 |
| B.平衡右移,达到平衡时容器压强一定增大 |
| C.平衡不一定发生移动,容器内压强一定增大 |
| D.平衡右移,SO2的转化率提高 |
下列从混合物中分离出其中的一种成分,所采取的分离方法正确的是
| A.由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| B.水的沸点为100oC,酒精的沸点为78.5oC,所以可用加热蒸馏方法,使含水的酒精变为无水酒精 |
| C.四氯化碳和水混合后,可用分液的方法来分离 |
| D.NaCl溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl溶液中分离得到纯净的NaCl |
已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是
| A.分液 | B.蒸馏 | C.过滤 | D.蒸发 |
以下实验装置一般不用于分离物质的是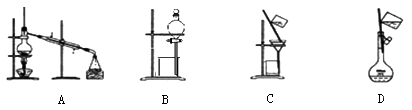
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入
| A.0.15 mol CuO | B.0.05 mol Cu2(OH)2CO3 |
| C.0.075mol Cu(OH)2 | D.0.1 mol CuCO3 |
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法正确的是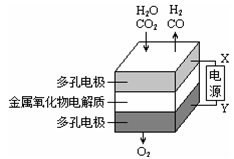
| A.X是电源的正极 |
| B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ、CO2+2eˉ=CO+O2ˉ |
C.总反应可表示为:H2O+CO2 H2+CO H2+CO |
| D.阴、阳两极生成的气体的物质的量之比是1︰1 |