第三周期元素R,它的最外层达到饱和时所需电子数小于次外层和最内层电子数之差,并且等于最内层电子数的正整数倍,则关于R的正确说法 ( )
①常温下能稳定存在的R的氧化物都是酸酐; ②R的气态氢化物都能受热分解。
③R元素都能以游离态存在于自然界中 ④R的最高价氧化物对应水化物都是强酸;
⑤R的氢化物在空气中都能燃烧生成+4价R的氧化物
⑥R的单质固态时属于同一类型的晶体;
⑦R的含氧酸根都不能稳定存在于c(H )/c(OH
)/c(OH )
) 的溶液中;
的溶液中;
| A.①③⑥ | B.①②④ | C.①②⑤⑦ | D.③⑤⑥⑦ |
将下图所示实验装置的 K 闭合,下列判断正确的是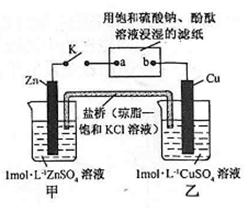
| A.Cu 电极上发生还原反应 |
| B.电子沿 Zn→a→b→Cu 路径流动 |
| C.片刻后甲池中c(SO42-)增大 |
| D.片刻后可观察到滤纸b点变红色 |
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl— Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl— |
| D.断开K1,闭合K2时,石墨电极作正极 |
用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是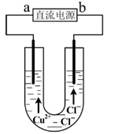
| A.a端是直流电源的负极 |
| B.通电使CuCl2发生电离 |
| C.阳极上发生的反应:Cu2++2e-=Cu |
| D.通电一段时间后,在阴极附近观察到黄绿色气体 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是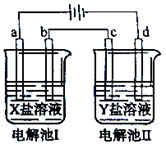
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
Pb(NO3)2 |
| C. |
FeSO4 |
Al2 (SO4)3 |
| D. |
CuSO4 |
AgNO3 |
用石墨作电极电解CuSO4溶液,通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的
| A.CuSO4 | B.H2O | C.CuO | D.CuSO4·5H2O |