在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
Ksp[Fe(OH)3] =2.6×10-39; Ksp[Cr(OH)3] =7.0×10-31;
Ksp[Zn(OH)2] =1.0×10-17; Ksp[Mg(OH)2] =1.8×10-11;
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
| A.Fe3+ | B.Zn2+ | C.Cr3+ | D.Mg2+ |
某同学弄清氨的喷泉实验原理后有了一个创新的设计:如果改换一下烧瓶内的气体和胶头滴管与烧杯中的液体,也能做成喷泉实验。那么下列各组中的气体和液体不符合该学生设计的一组是: ()
| A.SO2和NaOH溶液 | B.CO2和NaOH溶液 | C.O2和水 | D.Cl2和NaOH溶液 |
下列关于说法或操作中不正确的是()
| A.不慎将水银温度计打碎在地上,可在水银上覆盖一层硫磺粉以避免发生汞中毒 |
| B.浓H2SO4时不慎沾在皮肤上,用布擦后,用水冲洗,再用NaHCO3溶液(3-5%)冲洗 |
| C.浓硫酸具有吸水性,因而能使蔗糖炭化 |
| D.浓硫酸在常温下能够使铁、铝等金属钝化 |
下列化工生产过程所发生的反应不属于氧化还原反应的是 ( )
| A.煅烧大理石(主要成分为CaCO3) |
| B.用铝土矿(主要成分为Al2O3)制金属铝 |
| C.用氯气和消石灰制漂白粉[主要成分为Ca(ClO)2和CaCl2] |
| D.用氢气和氮气合成氨(NH3) |
.①臭氧空洞 ②水体富营养化 ③光化学烟雾 ④温室效应 ⑤酸雨,上述污染现象主要与NO2有关的是 ()
| A.①②③④ | B.①③④⑤ | C.①③④ | D.①③⑤ |
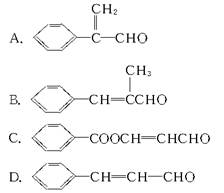
在10%稀碱催化下,醛与醛分子间能发生如下反应:

苯甲醛和乙醛发生上述反应生成的是( )