决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),已知3种离子晶体的晶格能数据如下表: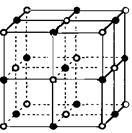
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如右图所示,其分子内不含有 (填序号)。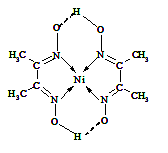
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
已知Zn和Fe2O3在高温下发生反应:3Zn + Fe2O3 =" 2Fe" + 3ZnO,其中Zn是____________剂,被_______________,发生__________反应。氧化产物是_______还原产物是 ________。
1.5 mol O2的质量为_____________ g,标况下体积为_________ L。0.5mol H2O中含电子数为_________________mol
(1)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个化学反应方程式表示其变化:① ,② 。
(2)金属钠着火时要用 灭火,请写出Na2O2与水的离子方程式
(3)用离子方程式表示实验室用Al2(SO4)3溶液制Al(OH)3的最佳方案 ,制备时为什么不能用NaOH溶液 (用化学方程式解释)。
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢。当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出肼的结构式 ,过氧化氢的电子式 。
(2)写出该反应的热化学方程式: 。
(3)已知H2O(1) = H2O(g) △H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为 kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是: 。
(5)发射卫星可用气态肼为燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。
已知:N2(g)+2O2(g) = 2NO2(g)△H=+67.7kJ·mol-1…………①
N2H4(g)+O2(g) = N2(g) +2H2O(g)△H=-543kJ·mol-…………②
请选择书写气态肼和二氧化氮反应的热化学方程式的计算表达式可以为:
| A.①-②×2 | B.①×2-② | C.②×2-① | D.②-①×2 |
原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置: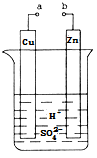
(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。