Ⅰ 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布图是_________________。
(2)C、N、O 三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H 键断裂,则形成的π 键有________mol。
Ⅱ 金属镍在电池、合金、催化剂等方面应用广泛。
(4)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______。
(5)甲醛(H2C=O)在Ni 催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C 原子的杂化方式为________。
Ⅲ 氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(6)写出N2H62+与碱溶液反应的离子方程式 ;
(7)写出N3-等电子体物质的化学式 ;(一种)
I:钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。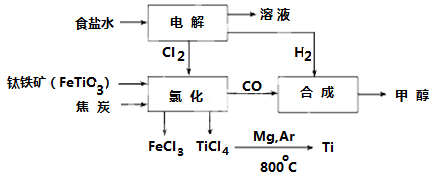
请回答下列问题:
(1)Fe位于元素周期表中第________周期,第________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
Ⅱ:A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。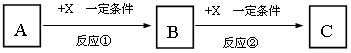
试回答:
(1)若X是强氧化性单质,则A不可能是________________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)____________。
(3)A还可以是氨气,氨气分子的空间构型是 。
氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步具有极其重要的意义。
(1)已知:2BrO3﹣+C12=Br2+2C1O3﹣;
5C12+I2+6H2O=2HIO3+10HC1;
C1O3﹣+5C1﹣+6H+=3C12+3H2O
则C1O3﹣、BrO3﹣、IO3﹣、C12的氧化性由弱到强的排序为
(2)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明,(提示:请写出实验步骤、现象及结论)①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液 ;
(3)二十世纪初期,化学家合成出极易溶于水的NaBH4.在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2﹣形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
(4)某强氧化剂[RO(OH)2]+能将Na2SO3氧化.已知含2.0×10﹣3mol[RO(OH)2]+离子的溶液,恰好跟25.0mL 0.2mol/L 的Na2SO3溶液完全反应,则反应后R的化合价为 价;
(5)将32g 铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
①待产生的气体全部释放后,向溶液加入V mL amol•L﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L.(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%H202的质量为 g。
氮化硼(BN)是一种重要的功能陶瓷材料,请回答下列问题: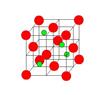
(1)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______;BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼晶胞,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g)△ H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
①增大压强②增大反应物的浓度③使用催化剂④降低温度
(3)①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,画出反应及收集的简易装置实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)。如图所示: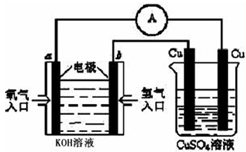
右边Cu电极反应式是
a电极的电极反应式
Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + a Na2O2 = 2Na2FeO4 + b X + 2Na2SO4 + c O2↑
该反应中物质X应是 ________ ,b与c的关系是 ___________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: _________________。
②每生成1mol FeO42-转移 _______ mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是_______________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为_______________(用含a、b的代数式表示)。