某化学小组研究在其他条件不变时,改变密闭容器中某一条件对
 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是 
A.在 和 和 不变时达到平衡, 不变时达到平衡, 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |
B.若 > > ,则正反应一定是放热反应 ,则正反应一定是放热反应 |
C.达到平衡时 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
D.若 > > ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为 > > |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| B.100 mL 0.1 mol·L-1 Na2CO3溶液中,离子总数是0.03NA |
| C.标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
下列解释事实的化学方程式或离子方程式正确的是
| A.用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2O |
| B.碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH-==CO32-+ NH3•H2O +H2O |
| C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I-= 2Fe 2+ + I2 |
D.Ca(HCO3)2溶液中加入少量的NaOH溶液: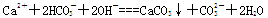 |
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是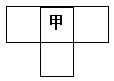
| 甲 |
||
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素乙在周期表中的位置为第2周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如右图所示。下列判断正确的是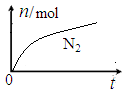
| A.该反应的还原剂是Cl— |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
对下列反应①KHCO3溶液与石灰水反应、②Na2SO3溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应。改变反应物用量,不能用同一个离子方程式表示的是
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |