下列离子方程式中书写不正确的是
| A.大理石与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.水玻璃中加入稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ |
| C.二氧化硅与苛性钠溶液反应:SiO2+2OH-=SiO32-+H2O |
| D.澄清石灰水通入过量CO2的总反应:CO2+OH-=HCO3- |
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是( )
| A.c(H+) | B.Ka(HF) | C.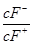 |
D.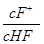 |
一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(s),以下能说明反应达到平衡标志的()
Y(g)+Z(s),以下能说明反应达到平衡标志的()
| A.混合气体的压强不再变化 |
| B.X、Y、Z的物质的量之比为2:1:1 |
| C.单位时间内生成lmolY的同时分解2mol X |
| D.X的分解速率与Y的消耗速率相等 |
.可逆反应达到平衡的根本原因是()
A反应混合物中各组分的浓度相等 B.正逆反应都还在继续进行
C.正逆反应的速率均为零 D.正逆反应的速率相等
下列措施对增大反应速率明显有效的是()
| A.铝在氧气中燃烧生成Al2O3,将铝粉改成铝片 |
| B.铁与稀硫酸反应制氢气时,改用质量分数为98.3%的浓硫酸 |
| C.锌与稀硫酸反应制氢气时,适当提高溶液的温度 |
| D.钠与水反应时增大水的用量 |
将4 mol A气体和2 mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)  2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是 ( )
2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是 ( )
| A.用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 | B.2s时的压强是起始时的1.1倍 |
| C.2s时物质A的转化率为30% | D.2s时物质B的浓度为0.7 mol•L-1 |