下列有关实验操作、现象和解释或结论都正确的是
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
过量的Fe 粉中加入稀HNO3,充分反应后,滴入KSCN 溶液 |
溶液呈红色 |
稀HNO3将Fe 氧化为Fe3+ |
| B |
某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 |
有白色沉淀出现 |
该钾盐是K2CO3 |
| C |
Al 箔插入稀HNO3中 |
无现象 |
Al 箔表面被HNO3氧化,形成致密的氧化膜 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
巴豆酸的结构简式为CH3CH="CHCOOH" ,现有①水;②溴的四氯化碳溶液;③乙醇;④纯碱溶液;⑤酸性KMnO4溶液,在一定条件下能与巴豆酸反应的物质组合是()
| A.只有②④⑤ | B.只有②③⑤ | C.只有②③④⑤ | D.①②③④⑤ |
等物质的量的乙醇、乙烷、乙炔(C2H2)完全燃烧消耗的氧气的物质的量之比为()
| A.6∶7∶5 | B.1∶1∶1 | C.35∶30∶42 | D.3∶5∶4 |
分子中有3个-CH3的C7H16,其可能的结构有 ()
| A.3种 | B.4种 | C.5种 | D.6种 |
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是()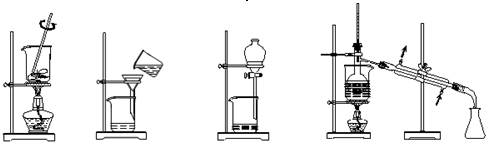
A B CD
| A.海带灼烧成灰 | B.过滤得含I—溶液 | C.从下口放出碘的苯溶液 | D.分离碘并回收苯 |
工业生产中物质制备时,通过下列的反应原理一步完成获得产物,符合“绿色化学”原则的反应原理是()
| A.加成反应 | B.分解反应 | C.取代反应 | D.置换反应 |