A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)E在周期表中的位置为__________________________;D的最高价氧化物的水化物的电子式___________________________。
(2)B、C的氢化物稳定性顺序为(用分子式表示,由大到小)_________>__________。
(3)B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z的名称为____________________,Z的化学键类型为____________________。
(4)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为_____________________________________。
(5)一定量的D2C2与AC2反应后的固体物质,恰好与含0.8mol HCl的稀盐酸完全反应,并收集0.35 mol 气体,则固体物质的组成为(写清成分和物质的量)____________________。
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质; F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸; C和D是两种常见的强酸。请回答下列问题: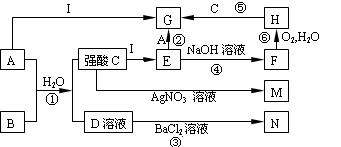
(1)写出物质B和M的化学式:B.,M ;
(2)写出反应②的离子方程式:;
(3)写出反应⑥的化学方程式:;
(4)在反应①②③④⑤⑥中,属于氧化还原反应的有: 。(填编号)
(1)下列物质中水溶液能导电但属于非电解质的有(填序号)①乙醇 ②氨气 ③氯气 ④氯化钠 ⑤硫酸 ⑥干冰 ⑦BaSO4 ⑧醋酸 ⑨氢氧化钠 ⑩CaO
(2)某实验需要使用240ml 0.4mol/L CuSO4溶液,用胆矾配制该浓度溶液需要使用的仪器有托盘天平、烧杯、玻璃棒、、;需要称量克胆矾;若所称胆矾失去部分结晶水,则配制出的溶液浓度。(填偏高、偏低或无影响)
(3)汉紫是中国古代兵马俑和古代壁画中的一种颜料,其化学式是BaCuSi2O6,请用氧化物的形式表示其组成:。
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++ O2+ 4H+=4Fe3++ 2H2O,则另一反应的离子方程式为;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g)△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式。
亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
(1)加入新制氯水后溶液中发生的离子反应方程式是_________________________、
Fe3+ +SCN- [Fe(SCN) ]2+。
[Fe(SCN) ]2+。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是(填编号)_____________________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是______(填序号)。
A.蒸馏水B.稀盐酸C.稀硫酸D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正v逆(填“>”、“<”或“=”,下同)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将amol•L-1的氨水与bmol•L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2•L-2,Ksp[AgI]=1.5×10-16mol2•L-2),在25℃下,向0.1L0.002mol•L-1的NaCl溶液中逐滴加入0.1L0.002mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是,向反应后的浊液中,继续加入0.1L0.002mol•L-1的NaI溶液,看到的现象是,产生该现象的原因是(用离子方程式表示) 。