设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
| A.标准状况下,1L庚烷所含有的分子数为NA/22.4 |
| B.1mol甲基(—CH3)所含电子数为9NA |
| C.标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数为16NA |
| D.26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
关于NaHCO3水溶液的表述正确的是
A.c (Na+ )= c (HCO3-) + 2c (CO32-) + c (H2CO3) )= c (HCO3-) + 2c (CO32-) + c (H2CO3) |
| B.c (OH-) + 2c (CO32-) + c (HCO3-) = c (H+) +c (Na+) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
| D.存在的电离平衡有: |
NaHCO3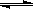 Na++HCO3—,HCO3—
Na++HCO3—,HCO3—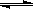 H++CO32—,H2O
H++CO32—,H2O 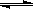 H++OH—
H++OH—
铅蓄电池效率低,污染大,目前正逐步被锌电池取代.锌电池的原料为锌、空气和电解质溶液,电池反应为2Zn+O2=2ZnO,下列关于锌电池的叙述中,正确的是
| A.锌为负极,空气进入负极发生反应 |
| B.正极发生氧化反应,负极发生还原反应 |
| C.负极电极反应是:Zn – 2e- +2OH-=ZnO+H2O |
| D.电池工作时,溶液的pH变小 |
下列说法正确的是
| A.H2S的水溶液中,c(H+)与c(S2—) 之比为2:1 |
| B.( NH4)2SO4溶液中c(NH4+)与c(SO42—) 之比为2:1 |
| C.一定温度下,将SO3 (g)放入密闭容器中反应达到平衡后,n(SO2)与n(O2) 比为2:1 |
| D.相同温度下,1mol/L的醋酸溶液与0.5mol/L醋酸溶液中c(H+)之比为2:1 |
在常温下,10mLpH=10的KOH溶液中,加入pH=4的CH3COOH溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
| A.c(CH3COO-)< c (K+) |
| B.c(H+) = c(OH-)< c(K+)< c(CH3COO -) |
| C.V总> 20mL |
| D.V总 < 20mL |
室温下,已知某溶液中由水电离出的c(H+)和c(OH-)浓度的乘积为10-24,则在该溶液中,一定不能大量存在的离子是[
| A.SO32- | B.HCO3— | C.NH4+ | D.NO3— |