列各组离子一定能在指定环境中大量共存的是( )
A.在c(H+)=10-10 mol/L的溶液中 Al3+、NH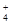 、Cl- 、NO 、Cl- 、NO |
B.pH值为13的溶液 K+ 、SO 、Na+、S2- 、Na+、S2- |
| C.水电离出来的c(H+)=10-12mol/L的溶液 K+、NH4+、Cl-、ClO- |
D.甲基橙呈红色的溶液中 Fe3+、Na+ 、SO42-、CO |
下列物质呈固态时必定属于分子晶体的是( )
| A.非金属氧化物 | B.金属氧化物 | C.非金属单质 | D.常温下呈气态的物质 |
在10L的容器中进行如下反应:N2 + 3H2 = 2NH3,3s后,NH3的物质的量增加0.12mol,用H2浓度的变化表示3s内的平均反应速率为()
| A.0.003mol•(L•s)-1 | B.0.045 mol•(L•s)-1 |
| C.0.006 mol•(L•s)-1 | D.0.009 mol•(L•s)-1 |
下列各组物质中,都是共价化合物的是()
| A.H2S和Na2O2 | B.H2O2和CaF2 | C.NH3和N2 | D.HNO3和HClO3 |
将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,则布条的颜色( )
| A.变白色 | B.变无色 | C.不褪色 | D.先褪色后又复原 |
NO因污染空气而“臭名昭著”,而奇妙的作用也使其成为“明星分子”。如可用于制HNO3、肥料、炸药、促进血管扩张、促进免疫功能、增强记忆等。下列各组物质中,不能生成NO的是()
| A.Cu + HNO3(稀) | B.N2 + O2 | C.NH4Cl + O2 | D.NO2 + H2O |