有一处于平衡状态的反应:X(s)+3Y(g)  2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应: A(s)+2B(g) C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是
| A.混合气体的压强 | B.混合气体的密度 |
| C.气体的总物质的量 | D.单位时间内生成n mol C的同时消耗2n molB |
若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
| A.c(Na+)= c(Ac—)+c(HAc) |
| B.c(Na+)+c(OH—)= c(Ac—)+c(H+) |
| C.c(Na+)>c(OH—) > c(Ac—) > c(H+) |
| D.c(Na+)> c(Ac—)> c(H+)> c(OH—) |
某小组为研究电化学原理,设计如图装置。下列叙述错误的是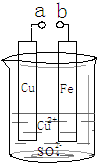
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动 |
| D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色 |
下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
下图为一原电池的结构示意图,下列说法中,错误的是 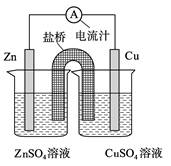
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |