25℃时,在0.1 mol·L-1的下列溶液中,微粒的物质的量浓度关系正确的是
| A.NH4Cl溶液中:c(NH4+)>c(Cl—)>c(H+)>c(OH-) |
B.NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO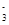 )>c(SO )>c(SO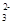 )>c(H2SO3) )>c(H2SO3) |
| C.CH3COONa溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
D.Na2CO3溶液中:2c(Na+)=c(CO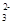 )+ c(HCO )+ c(HCO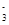 )+c(H2CO3) )+c(H2CO3) |
同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是()
| A.密度比为16∶11 | B.密度比为11∶16 |
| C.体积比为16∶11 | D.原子数比为1∶1 |
容量瓶是用来配制一定物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、
④压强、⑤刻度线、⑥酸式或碱式这六项中的()
| A.②④⑥ | B.③⑤⑥ | C.①②④ | D.①③⑤ |
下列说法正确的是()
| A.摩尔是7个基本物理量之一 |
| B.18 g水在标准状况下的体积约为22.4 L |
| C.27 g Al约含有6.02×1023个铝原子 |
| D.配制0.1 mol/L的NaCl溶液需NaCl固体的质量为5.85 g |
除去某物质里混有的少量杂质,下列做法中不正确的是(括号内的物质为杂质)
| A.KNO3溶液(AgNO3):加足量KCl溶液后过滤. |
| B.NaCl溶液(Na2CO3):加足量盐酸后加热. |
| C.KNO3固体(NaCl):溶解后加热蒸发得浓溶液,降温结晶后过滤. |
| D.NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热. |
下图所示的实验操作中,正确的是()