在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="=12" n(B)时,可断定x=4
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq), 某I2、KI混合溶液中, c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。
I3-(aq), 某I2、KI混合溶液中, c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。
下列说法正确的是
A.反应 I2(aq)+I-(aq) I3-(aq)ΔH>0 I3-(aq)ΔH>0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1 |
| C.若T1时,反应进行到状态d时,一定有υ正 >υ逆 |
| D.状态a与状态b相比,状态b时I2的转化率更高 |
下列关于甲、乙、丙、丁四幅图说法正确的是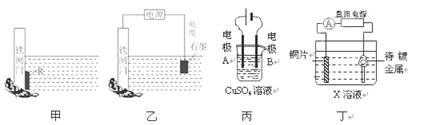
| A.装置甲中对于铁闸门的保护用的是“牺牲阳极的阴极保护法”,焊接在铁闸上的金属R可以是锡块 |
| B.装置乙中对于铁闸门的保护采用的是“外加电流的阴极保护法”,铁闸门应与直流电源的负极相连 |
| C.装置丙可实现电解精炼铜,电极A的材料用纯铜,电极B的材料用粗铜 |
| D.装置丁可实现镀铜,铜片接在电源的正极,待镀金属接在电源的负极,X溶液应用含有待镀金属阳离子的溶液 |
某种兴奋剂的结构简式如图所示,下列说法正确的是 ( )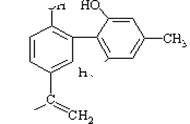

| A.该分子中的所有碳原子一定在同一个平面上 |
| B.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C.遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物 |
| D.1mol该物质分别与浓溴水、H2反应,最多消耗Br2和H2的物质的量分别为4mol、7mol |
某酯经水解后可得酸A及醇B,醇B经过氧化后可得A,该酯可能是 
| A.②④ | B.①③④ | C.①③⑤ | D.④⑤ |
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是
| 混合物 |
试剂 |
分离方法 |
|
| A |
苯(苯酚) |
NaOH溶液 |
分液 |
| B |
甲烷(乙烯) |
KMnO4溶液 |
洗气 |
| C |
乙酸乙酯(乙酸) |
NaOH溶液 |
蒸馏 |
| D |
溴苯(溴) |
苯、铁粉 |
过滤 |