实验室用锌粒与2mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是()
| A.用锌粉代替锌粒 | B.改用3mol/L硫酸溶液 |
| C.改用热的确2mol/L硫酸溶液 | D.向该硫酸溶液中加入等体积的水 |
下列化合物中,具有离子键、共价键的是()
| A.NaCl | B.KOH | C.Na2O | D.H2O |
下列叙述正确的是
| A.1molO2的质量为32g·mol-1 |
| B.1mol物质的质量等于该物质的相对分子质量或相对原子质量 |
| C.SO42-的摩尔质量为96 g·mol-1 |
| D.CO2的摩尔质量为44g |
设NA代表阿伏加德罗常数的数值,下列说法正确的是
A.22.4 L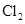 中含有NA个 中含有NA个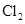 分子 分子 |
| B.标准状况下,22.4L水中的分子数为NA |
C.1 L 0.1 mol·L-1 溶液中有0.1NA个Na+ 溶液中有0.1NA个Na+ |
| D.NA个一氧化碳分子和0.5 mol水的质量比为28 :9 |
下列说法中不正确的是
| A.物质的量是一个物理量,物质的量的单位是摩尔 |
| B.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
| C.摩尔质量、气体摩尔体积、物质的量的浓度的单位分别是g/mol、L/mol、mol / L |
| D.标准状况下,2L二氧化碳和3L一氧化碳所含有的原子数目相等 |