前四周期元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。W可以与Y组成YW型化合物。请回答下列问题:
(1)W元素原子的L层电子排布式为 ,W3分子中的化学键类型 ;
(2)X单质与水发生主要反应的化学方程式为 ;
(3)X的氢化物沸点与同主族下一周期的元素的氢化物的沸点比较,沸点较高的是 ( 用化学式表示)原因是
(4)含有元素Z的盐的焰色反应为 色。许多金属的盐都可以发生焰色反应,其原因是 。
(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为______________________,相同温度下的溶解度B____________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸 ②碳酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
【改编】Ⅰ.M、A、B、C、D、E均为短周期主族元素,A的最外层电子数是M的4倍,A、B、C、D、E、F在周期表中位置如图所示。(请用化学用语作答)
| A |
B |
C |
D |
| E |
F |
(1)A在周期表中的位置 。
(2)D、E、F三种元素形成的简单离子半径由大到小的顺序为 。
(3)由M、B、C三种元素以原子个数比4:2:3形成化合物Q,Q中所含化学键类型有 。检验该化合物中阳离子的方法是 。(用离子方程式表示)。
(4)B与C可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
Ⅱ.一定条件下,2X(g)+Y(g) 2Z(g)+W(s)。
2Z(g)+W(s)。
(5)若反应在一定温度的恒容条件下进行,按下表数据投料,反应达到平衡状态,数据如下:
| 物质 |
X |
Y |
Z |
W |
| 起始投料/ mol |
2 |
1 |
2 |
0 |
| 平衡时物质的量 |
0.2 |
则平衡时容器的压强与原来压强的比值为________,X的转化率为__________。
(8分)用下面的原子或离子结构示意图的编号(A、B、C、D)填空: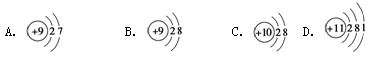
(1)核外电子层排布相同的是__________和___________;
(2)属于同种元素的是__________和__________;
(3)属于金属元素的是____________________;
(4)写出D参加化学反应后所得离子的结构示意图___ ____。
铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色沉淀,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为___________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
(1)元素M 的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为 。
(2)硫酸铝溶液与过量氨水反应的离子方程式为 。
(3)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是 (填序号)。
HSO3-+OH-水解平衡的事实是 (填序号)。
A.滴人酚酞溶液变红,再加人H2SO4溶液后红色退去
B.滴人酚酞溶液变红,再加人氯水后红色退去
C.滴人酚酞溶液变红,再加人BaCl2溶液后产生沉淀且红色退去
(4)元素X、Y在周期表中位于向一主族,化合物Cu2X和Cu2Y 可发生如下转化(其中D 是纤维素水解的最终产物):
①非金属性X Y(填“>”或“<”)
②Cu2Y与过量浓硝酸反应有红棕色气体生成,化学方程式为 。
(5)在恒容绝热(不与外界交换能量)条件下进行2A ( g ) + B ( g) 2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
| 物质 |
A |
B |
C |
D |
| 起始投料/mol |
2 |
1 |
2 |
0 |