标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是( )
| A.标准状况下,同体积的气体A和气体B的质量比为m∶n |
| B.25 ℃时,1 kg气体A与1 kg气体B的分子数之比为n∶m |
| C.同温同压下,气体A与气体B的密度之比为m∶n |
| D.标准状况下,等质量的A与B的体积比为m∶n |
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH—=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH—)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
下列离子方程式不正确的是( )
| A.三氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+ |
| B.4mol/L的NaAlO2溶液和7mol/L的HCL等体积互相均匀混合: 4 AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
| C.在Mn2+溶液中加入HNO3再加入PbO2.得紫红色溶液: 5PbO2+2Mn2++4H+=5 Pb2++2MnO4-+2H2O |
| D.将0.lmol/LNa2CO3溶液数滴缓缓滴入O.lmol/L 25mL盐酸中 |
2H++CO32-=CO2↑+H2O
当0.2mol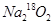 足量CO2完全反应后所得固体的质量为( )
足量CO2完全反应后所得固体的质量为( )
| A.21.2g | B.21.6g | C.22.0g | D.22.4g |
下列说法中正确的是( )
| A.分离Al2O3与Fe2O3混合物可以采取加入过量NaOH溶液充分反应后,过滤、洗涤、干燥 |
| B.用过量氨水除去Fe3+“溶液中的少量Al3+ |
| C.将Mg(OH)2放入表面皿中,加入足量盐酸,加热蒸干得无水MgCl2 |
| D.Al(OH)3中混有Mg(OH)2;加入足量烧碱溶液,充分反应过滤,向滤液中通入足量二氧化 |
碳后过滤、洗涤、干燥