某溶液中含有较大量的Cl—、CO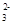 、OH—三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次沉淀出来,下列实验操作顺序正确的是( )
、OH—三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次沉淀出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
| A.①②④②③ | B.④②③②① | C.①②③②④ | D.④②①②③ |
下列叙述正确的是()
| A.海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t。由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
B.对于可逆反应N2(g)+3H2(g) 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大 |
| C.硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中 |
| D.阴极射线和α-粒子散射现象都对原子结构模型的建立做出了贡献 |
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| 1 |
用pH试纸检验 |
溶液的pH大于7 |
| 2 |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
| 3 |
分液,向上层溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| 4 |
过滤,向滤液中加入AgNO3溶液 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.不能确定的离子是③⑤
常温下,向一定体积的1mol.L-1的醋酸溶液中逐滴加入等浓度的氢氧化钠溶液,溶液中pOH和pH的变化如图所示,已知该条件下醋酸的电离程度为0.4%,则下列说法不正确的是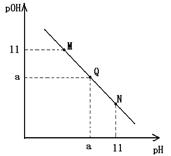
| A.a为7 |
| B.Q点的水的电离程度在整条曲线中最大 |
| C.M和Q之间(不含Q)的溶液离子浓度排序都满足c(CH3COO-)>c(Na+) |
| D.三点所代表的溶液导电能力,N最大,M最小 |
发展混合动力车是实施节能减排的重要措施之一。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)电解液。镍氢电池充放电原理总反应式为:H2+2NiOOH 2Ni(OH)2。下列有关混合动力车的判断正确的是:
2Ni(OH)2。下列有关混合动力车的判断正确的是:
| A.在上坡或加速时,乙电极周围溶液的pH将减小 |
| B.在上坡或加速时,溶液中的K+向甲电极迁移 |
| C.在刹车和下坡时,乙电极增重 |
D.在刹车和下坡时,甲电极的电极反应式为:2H2O+2e- H2↑+2OH- H2↑+2OH- |
下列说法正确的是:
| A.已知某温度下纯水中的c(H+)=2×l0-7mol.L-1,据此无法求出水中c(OH-) |
| B.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2.L-2 |
C.常温下 的溶液中存在Al3+、NH4+、Cl-、NO3- 的溶液中存在Al3+、NH4+、Cl-、NO3- |
| D.已知: |
| 共价键 |
C—C |
C=C |
C—H |
H—H |
| 键能/kJ·mol-1 |
348 |
610 |
413 |
436 |
由上表数据可以计算出反应 的焓变
的焓变