有下列A~F六种试剂,由于它们的性质不同,必须选用合适的试剂瓶盛装,请在各种试剂瓶后面的括号内填上所装试剂的序号。
试剂:A二氧化硅 B.硝酸银晶体 C氯水 D氢氟酸 E浓硫酸 FNaOH溶液
试剂瓶:
(1)磨砂玻璃塞的细口瓶( );
(2)广口瓶( );
(3)橡皮塞细口瓶( );
(4)棕色的广口瓶( );
(5)细口塑料瓶( )。
A、B、C、D、E五种物质之间的关系如下图所示,其中E为黑色物质,B为气体,C为金属,反应Ⅲ是C在D的稀溶液中进行的,则A为_______,B为______,D为______ 。
写出反应Ⅰ的离子方程式______________________________。
现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请完成下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为________________________________。
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42+等杂质离子,使用的试剂有:
a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为________________(填试剂序号)。
(3)如果在容积为10 L的离子交换膜电解槽中,1 min在阴极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变)________。
(4)Cl2常用于自来水的消毒杀菌,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为________。
如图所示,在大试管里放一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,将这个装置这样放置约一周后,观察到铁丝发生的变化是 _____________________,原因是___________________________________。试管内水面会上升,最终 上升高度大约为_______,原因是__________________________________________________。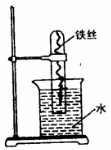
生活中常常有这样的现象:一件普通的铁器,如不精心保管,便会生锈;若不引起注意,锈斑蔓延开来,就会吞噬整个铁器使之变成废物。人们称这种现象为“锈吃铁”。请用相关学科知识解释“锈吃铁”这一自然现象。
请利用氧化还原反应Cu+2FeCl3====2FeCl2+CuCl2设计一个原电池。