实验室用食盐制纯碱的操作步骤是:
(1)向浓氨水中加入足量食盐晶体制取饱和氨盐水;
(2)向饱和氨盐水中通入足量的二氧化碳气体至有大量晶体析出;
(3)将操作(2)中产生的晶体过滤出来;
(4)将滤纸上的晶体转移至坩埚中,加热至不再有水蒸气产生,所得固体即为碳酸钠。
对上述信息的有关理解中,正确的是(双选)( )
| A.用食盐制纯碱还需要含碳元素的物质 |
| B.食盐水比氨盐水更易吸收二氧化碳 |
| C.室温下碳酸氢钠的溶解度比氯化铵的溶解度小,所以先结晶析出 |
| D.在氨盐水中如果没有未溶解的食盐晶体存在,说明溶液一定不饱和 |
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2 CH3CHBrCH2Br②CH3CH2OH
CH3CHBrCH2Br②CH3CH2OH  CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O④C6H6+HNO3
CH3COOCH2CH3+H2O④C6H6+HNO3 C6H5NO2+H2O
C6H5NO2+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
在实验室中,从苯酚中分离出苯,可选用下列装置中的( )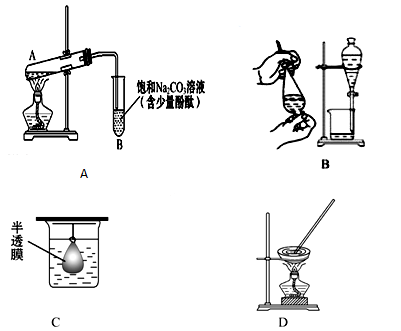
用丙醛(CH3-CH2-CHO)制取聚丙烯 [ CH2-CH(CH3)]n的过程中发生的反应类型为()
①取代②消去③加聚④缩聚⑤氧化⑥还原
| A.①④⑥ | B.⑤②③ | C.⑥②③ | D.②④⑤ |
据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:
HC≡C—C≡C-C≡C-C≡C-C≡N。对该物质判断正确的是()
| A.晶体的硬度与金刚石相当 | B.能使酸性高锰酸钾溶液褪色 |
| C.不能发生加成反应 | D.可由乙炔和含氮化合物加聚制得 |
下图是某有机物分子的比例模型,则该物质不具有的性质是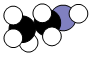
| A.使紫色石蕊变红 | B.与钠反应 |
| C.发生酯化反应 | D.发生氧化反应 |