可逆反应:
 在密闭容器反应,达到平衡状态的标志是( )
在密闭容器反应,达到平衡状态的标志是( )
(1)单位时间内生成n mol的O2的同时生成2n mol的NO2
(2) 单位时间内生成n mol O2的同时生成2n mol的NO
(3)用NO2 、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
| A.(1)(4)(5) | B.(2)(3)(5) |
| C.(1)(3)(4) | D.(1)(2)(3)(4)(5) |
在不同温度下,水溶液中c(H+)与c(OH-)有如下图所示关系。下列关于离子共存说法中正确的是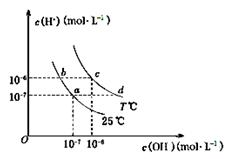
| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42— |
| B.b点对应的溶液中大量存在:NH4+、Ba2+、OH-、I- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO3— |
| D.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl- |
Cyrneine A对治疗神经系统疾病有着很好的疗效,其可以用香芹酮经过多步反应合成: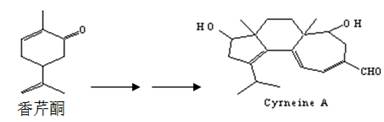
则下列有关的说法正确的是
| A.香芹酮化学式为C9H12O,其一氯代物有12种 |
| B.香芹酮分子中有8种不同化学环境的氢 |
| C.Cyrneine A可以发生加成反应、氧化反应、酯化反应等,但不能发生消去反应 |
| D.香芹酮和Cyrneine A均能够使溴水和酸性KMnO4溶液褪色 |
短周期元素W、X、Y和Z的原子序数依次增大。金属W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y的单质是常见的金属,可做海洋电池的负极材料。Z原子的质子数是同主族上一周期原子质子数的2倍。下列说法正确的是
| A.由金属W制备的高效电池可用NH4Cl溶液作电解质 |
| B.元素X与氢形成的化合物中不可能既有极性健又有非极性健 |
| C.元素Y、Z分别形成的简单离子,后者的离子半径较前者大 |
| D.元素Y、Z的最高价氧化物对应的水化物之间不能反应 |
下列有关的离子方程式书写正确的是
A.向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu + 4H+ + SO42- Cu2+ + SO2↑ + 2H2O Cu2+ + SO2↑ + 2H2O |
B.服用阿司匹林过量出现水杨酸(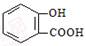 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: +2 HCO3- → +2 HCO3- →  + 2 CO2↑ + 2 H2O + 2 CO2↑ + 2 H2O |
| C.20mL 1.0mol/L的明矾溶液与10mL 3.5mol/LBa(OH)2溶液混合充分反应: 3Ba2+ + 6OH- +2Al3+ +3SO42- ="=" 3BaSO4↓+2Al(OH)3↓ |
| D.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3- +2OH-="=" CaCO3↓+2H2O+CO32- |
分子式为C5H10O2的有机物A,有果香味,在酸性条件下水解生成有机物B和C,其中C能被催化氧化成醛,则A可能的结构共有
| A.1种 | B.6种 | C.9种 | D.18种 |