配制一定物质的量浓度的某溶液,下列情况会使溶液浓度偏低的是( )
| A.未冷却即转移、定容 |
| B.容量瓶中原有少量蒸馏水 |
| C.定容时俯视刻度线 |
| D.摇匀后溶液倒入试剂瓶时,试剂瓶中原有少量水 |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s)ΔH <0,下列叙述正确的是
2Z(g)+W(s)ΔH <0,下列叙述正确的是
| A.平衡常数K值越大,X的最大转化率越大 |
| B.达到平衡时,反应速率v正(X)=2v逆(Z) |
| C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
下图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,
2C(g)(正反应为放热反应)的平衡移动图象,
影响平衡移动的原因可能是
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A.CH3OH(l)+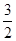 O2(g)===CO2(g)+2H2O(l)ΔH =+725.8 kJ/mol O2(g)===CO2(g)+2H2O(l)ΔH =+725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH =-1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O (l)ΔH =-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH =+1452 kJ/mol |
下列叙述中,不能用勒夏特列原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.加入催化剂有利于氨的合成 |
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
可逆反应H2(g)+I2(g)  2HI(g)达到平衡时的标志是
2HI(g)达到平衡时的标志是
| A.混合气体密度恒定不变 |
| B.混合气体的颜色不再改变 |
| C.H2、I2、HI的浓度相等 |
| D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等 |