已知在一定条件下,2mol H2完全燃烧生成液态水时放出热量572kJ,请回答下列问题: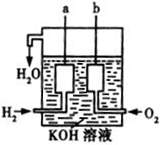
(1)反应物的总能量 (填“大于”、“小于”或“等于”)生成物的总能量。
(2)在此条件下,若反应生成含1molO-H键的液态水,则放出热量为 kJ;若2 mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)572 kJ。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:a、b两个电极均由多孔的碳块组成,一极通入H2 ,另一极通入O2,则 (填物质化学式)失电子作负极;正极电极反应式为: ;电池总反应为: 。
(8分)茉莉花香气的成分有多种,乙酸苯甲酯(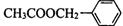 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: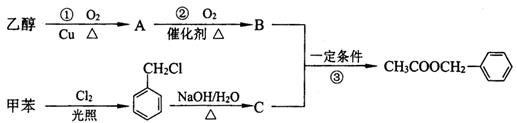
(1)写出反应①的化学方程式:。
(2)反应③的反应类型为。
(3)C的结构简式为。
(4)在①②③三个反应中,原子的理论利用率为100%,符合绿色化学的要求的反应是(填序号)。
某有机物A,它的氧化产物甲和还原产物乙都能和金属钠反应放出H2。甲和乙反应可生成丙,甲和丙均能发生银镜反应。有机物A是
| A.甲醇 | B.甲醛 | C.甲酸 | D.甲酸甲酯 |
(8分)将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示。
(1)当V1=140mL时,混合物中n(Mg)=_____mol,V2=_____mL。
(2)滴入的NaOH溶液_____mL 时,溶液中的Mg2+和Al3+刚好沉淀完全。
(3)若混合物中Mg的物质的量分数为a,当滴入的NaOH溶液为450mL时,所得沉淀中无Al(OH)3,则a的取值范围是____________________
已知几种离子的还原能力强弱顺序为I—>Fe2+>Br—,现有200mL混合溶液中含FeI2、FeBr2各0.10mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其它反应)。
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是,剩余Fe2+的物质的量为。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为,若最终所得溶液为400mL,其中主要阳离子及其物质的量浓度为。
(3)通过对上述反应的分析,试判断Cl2、I2、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式,上述所有反应共消耗Cl2mol。
在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl-、OH-、HCO3—、NO3—。已知该溶液能跟铝粉反应,且放出的气体只有H2。试回答:
(1)若溶液和铝粉反应后有AlO2-生成,则溶液中一定含有大量的_____________离子,还可能含有大量的________离子。
(2)若溶液和铝粉反应后有Al3+生成则溶液中一定含有大量的________离子,原溶液中一定不含有大量的________离子。