下面给出了四种烃A、B、C、D的相关信息:
①烃A在所有的烃中含碳的质量分数最低;
②烃B是一种植物生长调节剂,可用于催熟果实;
③烃C在氧气中燃烧产生的氧炔焰常用来切割或焊接金属;
④烃D的分子比例模型如右图所示: 。
。
据此回答有关问题:
(1)将A和Cl2按体积比1:4混合充入一试管,密封后置于光亮处,一段时间后能看到试管内的现象是 。
(2)写出把B通入溴的CCl4溶液中的化学方程式 ;反应类型是 。
(3)实验室制取C的化学方程式为 ;C通入KMnO4 酸性溶液中观察到的现象是 ,C发生了 反应。
(4) D分子中不存在一般的碳碳单键和碳碳双键交替结构,以下能证实这一事实的是 。
a.D的邻位二氯取代物不存在同分异构体
b.D的间位二氯取代物不存在同分异构体
c.D的对位二氯取代物不存在同分异构体
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下: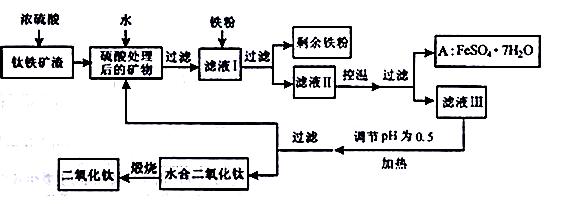
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是____________________________
(2)向滤液I中加入铁粉,发生反应的离子方程式为:______________________、
________________________________。(各2分)
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:__________________________
(4)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、_____________、___________________(填化学式,各2分),减少废物排放。
(5)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_____________kg
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与少量的NaOH溶液反应的化学方程式:
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中每转移2.5mol的电子则参加反应的还原剂的物质的量为mol.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、OH
、OH 和SO
和SO .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设 .
假设1:只存在SO32-;假设2:只存在ClO
假设3:既不存在SO32-也不存在ClO ;
;
假设4:.
②设计实验方案进行实验。请在答题卡上写出实验步骤以及预期现象和结论
限选实验试剂:3moL L-1H2SO4、0.01mol
L-1H2SO4、0.01mol L-1KMnO4、紫色石蕊试液.(每空2分)
L-1KMnO4、紫色石蕊试液.(每空2分)
| 实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
|
| 步骤2: |
|
| 步骤3: |
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为常见的致冷剂,化合物M由两种元素组成,分子内共有58个电子。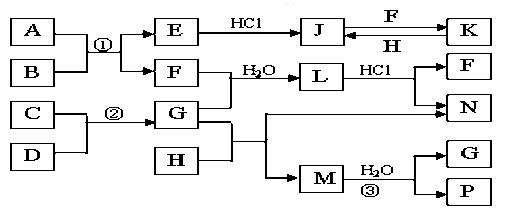
(1)化合物A中含有的两种元素是 (写元素符号)M的化学式_______
(2)如何检验化合物N中的阳离子
(3)写出K与H反应的离子方程式:
C与D反应的化学方程式:
(4)等物质的量F和H的混合气体通入品红溶液中的现象为 ,原因是(用离子反应方程式表示)
(5)实验中可用NaOH溶液来吸收多余的H,请写出此离子反应方程式
(2分)
某化学课外小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。请回答下列问题:
(1)写出装置A中主要反应的化学方程式(2分)
(2)如何检查装置A的气密性(2分)
(3)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,写出该反应的热化学方程式(2分)
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是________(2分)
| A.升高温度 | B.降低温度 | C.增大压强 | D.增大压强 |
(4)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是______(2分)
(5)装置C中浓H2SO4的作用是(2分)
(6)请你帮助该化学小组设计实验室制取NH3的另一方案(用化学反应方程式表示)
物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,
F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。若用两根玻璃棒分别蘸取A、G的浓溶 液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
(1)①反应的化学方程式是 。
(2)②③两步反应的离子方程式分别是,
。
(3)在④的反应中,每1molE参加反应,将会有 mol电子发生转移。