(1)在层析法分离Fe3+和Cu2+的实验中,层析操作后,滤纸未经氨熏,可观察到滤纸表面有________和________的斑痕。
(2)为使观察效果更明显,实验中采用氨熏显色。请写出Fe3+、Cu2+分别与足量氨水反应的离子方程式_____________________________________________________________
________________________________________________________________________、
________________________________________________________________________。
(3)显色反应结果是滤纸上方颜色呈红棕色,下方呈深蓝色(均在原点之上)说明Fe3+和Cu2+得到了分离。由此可以得出Fe3+和Cu2+在流动相和固定相中的分配情况是
________________________________________________________________________
________________________________________________________________________。
(4)实验中所使用的FeCl3饱和溶液通常会出现浑浊现象,解决的办法是
________________________________________________________________________。
(5)纸层析分离的基本原理是:亲脂性强的成分在流动相中分配的多一些,随流动相移动的速度就快一些;亲水性强的成分在固定相中分配的多一些,随流动相移动的速度就慢一些。请你根据上述实验现象,描述Fe3+和Cu2+得到分离的原因
________________________________________________________________________
________________________________________________________________________。
已知反应:①SO3+H2O====H2SO4 ②Cl2+H2O====HCl+HClO
③2F2+2H2O====4HF+O2↑ ④2Na+2H2O====2NaOH+H2↑
⑤2Na2O2+2H2O====4NaOH+O2↑ ⑥SiO2+2NaOH====Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有__________(填序号,下同)。H2O被氧化的是___________,H2O被还原的是____________。属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的有_____________。
(2)写出方程式②的离子方程式_____________。
(3)用双线桥标出方程式④中电子转移的方向和数目_______________。
质子交换膜燃料电池广受关注.
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:C(s)+1/2O2(g)═CO(g) △H1=﹣110.35kJ·mol﹣1
2H2O(l)═2H2(g)+O2(g) △H2=+571.6kJ·mol﹣1
H2O(l)═H2O(g) △H3=+44.0kJ·mol﹣1
则C(s)+H2O(g)═CO(g)+H2(g) △H4= .
(2)燃料气(流速为1800mL·h﹣1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 .
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为 .
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示.加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好.催化剂为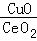 - HIO3,120℃时,反应1h后CO的体积为 mL.
- HIO3,120℃时,反应1h后CO的体积为 mL.
(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为
(1)在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,则表示甲烷燃烧热的热化学方程式为_________________ 。
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为 。
(3)如图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
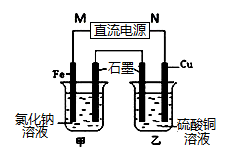
(4)下图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mol e-发生转移时,左右两侧溶液的质量之差为 (忽略气体的溶解,假设反应物完全耗尽)。
食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:
请回答下列问题:
(1)定温度下,向0.1 mol·L-1 CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
a.溶液的pH增大
b.CH3COOH的电离程度增大
c.溶液的导电能力减弱
d.溶液中c(OH- ).c(H+)不变
(2)25℃时,0.10 mol·L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____ mol·L-1。
(3)常温下,将20 mL 0.10 mol·L-1CH3COOH溶液和20 mL 0.10 mol·L-1HNO2溶液分别与20 mL 0.10 mol·L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH)_________v(HNO2)(填“>”、“<”或“:”),原因是_________.
②充分反应后.两溶液中c(CH3COO-)_________c(NO2-)(填“>”、“<”或“=”)。
(4)25 C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中
C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =__________。
=__________。
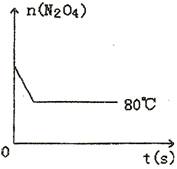
在80℃时,0.40mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
已知:
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K= 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号) 。
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO2 |
| C.使用高效催化剂 | D.升高温度 |
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。