已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z基态原子的核外电子排布式是 ;
(2)X、Y可组成一化合物,其原子个数之比为5:1。其化学式中含有的化学键有 。
(3)YX3分子的空间构型是 ,中心原子的杂化方式是 ;Y的氢化物的沸点比W的氢化物的沸点 (填“高”或“低”)。
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z 2W2的电子式为 。
利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法 |
| B.若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法 |
| D.若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH- |
下图所示装置的叙述,正确的是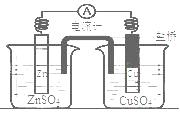
| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的阳离子会移向CuSO4溶液 |
| C.正极附近的SO42-离子浓度逐渐增大 |
| D.锌离子在锌片表面被还原 |
反应2SO2+O2  2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol•L-1•s-1,则这段时间为
2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol•L-1•s-1,则这段时间为
| A. 0.1 s | B. 2.5 s | C. 5 s | D. 10 s |
下列溶液均处于25℃,有关叙述正确的是
| A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中c(H+) 是pH=6.5的牛奶中c(H+)的100倍 |
常温下,某一元酸HA溶液的pH为b,且有n(A- ):n(HA)=1:99.某一元强碱溶液pH为A.若将1体积的此强碱溶液与10体积的HA溶液混合,恰好完全反应.则a与b之和为
A.15 B.16 C.17 D.18