人的胃液是一种强酸性液体,pH在0.9~1.5之间,氢氧化铝是一种治疗胃酸过多的胃药的主要成分。目前这种胃药已不常用,原因主要是( )
| A.长期摄入铝元素不利于人体健康 |
| B.它不能中和胃液 |
| C.它不易溶于胃液 |
| D.它的疗效太差 |
将4gNaOH溶解在10mL水中,再稀释成1L,稀释后溶液的物质的量浓度是
| A.1mol·L-1 | B.0.1mol·L-1 | C.0.001mol·L-1 | D.10mol·L-1 |
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是
| A.950mL,111.2g | B.500mL,117g |
| C.1000mL,117g | D.任意规格,111.2g |
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是 ( )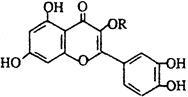
| A.可以和溴水反应 |
| B.可用有机溶剂萃取 |
| C.分子中有三个苯环 |
| D.1mol维生素P可以和4molNaOH反应 |
某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是
()
| A.HCl和CO | B.HCl、H2和CO | C.CH4和NH3 | D.HCl、CO和CO2 |
在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是 ()
| A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量小 |
| B.两烧杯中参加反应的锌等量 |
| C.甲烧杯中的酸过量 |
| D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |