设C + CO2 2CO
2CO  的反应速率为
的反应速率为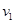 ,N2 + 3H2
,N2 + 3H2 2NH3⊿H<0的反应速率为
2NH3⊿H<0的反应速率为 ,对于上述反应,当温度升高时,
,对于上述反应,当温度升高时,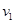 和
和 的变化情况为( )
的变化情况为( )
| A.同时增大 | B.同时减小 | C.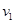 增大, 增大, 减小 减小 |
D.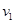 减小, 减小, 增大 增大 |
下列溶液,加热后颜色变浅的是
| A.稀氨水和酚酞溶液 | B.滴有酚酞的Na2CO3溶液 |
C.溶有氯气的品红溶液 |
D.溶有SO2的品红溶液 |
有关晶体的下列说法中正确的组合是
①晶体中分子间作用力越大,分子越稳定②.原子晶体中共价键越强,熔点越高
③冰熔化时水分子中共价键发生断裂④.氯化钠熔化时离子键未被破坏
⑤熔化时无需破坏化学键的 晶体一定是分子晶体⑥.元素周期表从ⅢB族到ⅡB族8个纵行的元素都是金属元素⑦.在 SiO2和干冰晶体中,都存在单个分子
晶体一定是分子晶体⑥.元素周期表从ⅢB族到ⅡB族8个纵行的元素都是金属元素⑦.在 SiO2和干冰晶体中,都存在单个分子
⑧.分子晶体不都是共价化合物
| A.①②⑤ | B.②④⑤ | C.②⑤⑧ | D.①④⑦ |
下列对化学知识概括合理的是
| A.两种元素构成的共价化合物分子中的化学键都是极性键 |
| B.含有非极性键的化合物一定是共价化合物 |
| C.只要是离子化合物,其熔点就一定比共价化合物的熔点高 |
| D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
设NA为阿伏加德罗常数,下列说法中不正确的是
| A.质子总数为5NA的重水(D2O)的物质的量是0.5mol |
| B.在标准状况下,11.2L甲烷和乙烯的混合物所含氢原子的数目为2NA |
| C.任何条件下,等物质的量的SO3和NH3所含原子数一定相等 |
D.常温常压下,NA个甲烷分子的体积小于22.4 L L |
下列含有极性键的非极性分子
①NH3②BF3③N2 ④CO2⑤CH4⑥H2S ⑦SO2⑧CS2 ⑨H2O ⑩HF
| A.②③④⑤ | B.①④⑤⑨ | C.②④⑤⑧ | D.④⑤⑦⑧ |