短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题: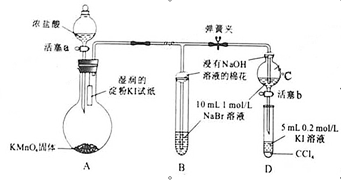
(1) 写出C的化学式 ,H的化学式 。
(2) B与氢氧化钠溶液反应的化学方程式为: 。
(3) G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为 ,当生成2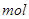 二氧化氯时,转移电子
二氧化氯时,转移电子 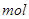 。
。
(4) 溶液F在空气中长期放置生成H的化学反应方程式为:
。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题
⑴第1步:灼烧。操作是将足量海带放到灼烧成灰烬。A.试管 B.瓷坩埚
⑵第2步:Iˉ溶液的获取。操作是将灰烬转到烧杯中,加适量蒸馏水,用充分搅拌,煮沸,。(填操作名称)
⑶第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用。(填代号)A.新制氯水 B.H2O2 C.KMnO4溶液理由是。
⑷第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: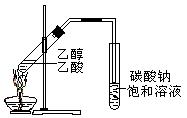
(1)写出制取乙酸乙酯的化学反应方程式
(2)浓硫酸的作用是:①;②。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是
防止。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号)。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。
D处使用碱石灰的作用是。
(3)检验乙醇氧化产物时F中的实验现象是。
(4) E处是一种纯净物,其反应方程式为。
(5)写出乙醇发生催化氧化的化学方程式。
已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,某探究小组用KMnO4酸性溶液与H2C2O4(草酸)溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol· L—1、0.0010 mol· L—1,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol· L—1)的用量均为2 mL。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
催化剂的用量 / g |
酸性KMnO4溶液的浓度/mol·L-1 |
实验目的 |
| ① |
298 |
0.5 |
0.010 |
a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究温度对反应速率的影响; c. 实验①和④探究催化剂对反应速率的影响。 |
| ② |
||||
| ③ |
||||
| ④ |
(2)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 |
溶液褪色所需时间 t / min |
||
| 第1次 |
第2次 |
第3次 |
|
| ① |
14.0 |
13.0 |
11.0 |
| ② |
6.5 |
6.7 |
6.8 |
则实验②中用KMnO4的浓度变化来表示的平均反应速率为(忽略混合前后溶液的体积变化)。
(将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。
(1)图中A、B、C三种仪器的名称是_________。。
(2)将以上仪器按(一)→(六)顺序,用字母a,b,c,…表示连接顺序:
e接( );( )接( );( )接( );( )接( );( )接( )
(3)A仪器中c口用于_________,d口用于_________。
(4)蒸馏时,温度计水银球应在_________位置。
(5)在B中注入原油后,加几片碎瓷片的目的是_________。