已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6 mol·L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片用水冲洗、烘干后称量,得质量为m2。下列说法正确的是(双选)( )
A.设锌镀层单侧厚度为h,锌的密度为ρ,则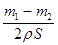 =h =h |
| B.锌电极上发生还原反应 |
| C.锌和石墨形成原电池,外电路中电流从锌流向石墨 |
| D.当石墨不再产生气泡时,应立即取出铁皮 |
已知Zn+Cu2+=Cu+Zn2+,能实现该反应的原电池的正确组成是( )
| A |
B |
C |
D |
|
| 正极 |
Zn |
Cu |
Zn |
Fe |
| 负极 |
Cu |
Zn |
Ag |
Zn |
| 电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
CuCl2 |
下图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述中不正确的是( )
| A.a电极是负极 |
| B.b电极的电极反应式为4OH--4e-=2H2O+O2↑ |
| C.在电池内部,H+向b电极附近运动 |
| D.氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是( )
| A.H2和Cl2 | B.Cu和Cl2 | C.H2和O2 | D.Cu和O2 |
下列装置能构成原电池的是( ) 
为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5 mL 0.5 mol•L-1 KI溶液,滴加0.1 mol•L-1 FeCl3溶液5~6滴,充分反应。下列实验操作能验证该反应是否存在限度的是( )
| A.再滴加AgNO3溶液,观察是否有黄色沉淀产生 |
| B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色 |
| C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察有否白色沉淀产生 |
| D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变血红色 |