下列关于定量实验中的基本操作和仪器的描述正确的是(双选)( )
| A.用托盘天平称取20.00 g NaOH固体 |
| B.用酸式滴定管准确量取20.00 mL K2Cr2O7溶液 |
| C.用电子(分析)天平测得铁片质量是15.524 g |
| D.在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度线持平 |
下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH 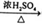 CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④2CH3CH2OH 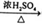 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
| A.先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| B.先加足量溴水,然后再加入酸性高锰酸钾溶液 |
| C.分别点燃这两种液体,观察现象 |
| D.加入浓硫酸与浓硝酸后加热 |
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=S2 (g)+2H2O(g) △H2
③H2S(g)+O2(g)=S(g)+H2O(g) △H3
④ 2S(g) =S2(g)△H4
则△H4的正确表达式为
| A.△H4=(△H1+△H2-3△H3) | B.△H4=(3△H3-△H1-△H2) |
| C.△H4=(△H1+△H2-3△H3) | D.△H4=(△H1-△H2-3△H3) |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( ) 
| A.c点处正反应速率和逆反应速率相等 |
| B.a点处正反应速率比b点处的大 |
| C.d点(t1时刻)和e点(t2时刻)处n(N2)不同 |
| D.t2时刻,正反应速率大于逆反应速率 |
可逆反应:2NO2(g) 2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ |
| C.①③④⑤ | D.全部 |