现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积约6 mL和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接__________,B接__________;
(2)碳棒接直流电源的________极,电极反应式为
________________________________________________________________________
________________________________________________________________________;
(3)能说明氯气具有氧化性的实验现象是
________________________________________________________________________
________________________________________________________________________;
(4)假定装入U形管的饱和食盐水为50 mL(电解前后溶液的体积变化可忽略),当测得生成的氢气为5.6 mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为________;
(5)用离子方程式表示电解饱和食盐水的总反应:
________________________________________________________________________
________________________________________________________________________;
氯气与NaOH溶液反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)△H 1=" -" 90.7 kJ·mol-1
CH3OH(g)△H 1=" -" 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)△H3 =" -" 41.2 kJ·mol-1
CO2(g)+H2(g)△H3 =" -" 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为。
(4)图为绿色电“二甲醚燃料电池”的工作原理示意图。
该电池工作时,H+向极移动(填“正”或“负”);a电极的电极反应式为。
某科研小组设计出利用工业废酸(稀H2SO4)浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是。
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间。
(5)物质B可直接用作氮肥,则B的化学式是。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式。
将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成:

请回答下列问题:
(1)美托洛尔中的含氧官能团为和(填名称)。
(2)反应③中加入的试剂X的分子式为C2H5OCl,X的结构简式为。
(3)在上述①②③三步反应中,属于取代反应的是(填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应Ⅱ.能与FeCl3溶液发生显色反应
Ⅲ.分子中有4种不同化学环境的氢,且1 mol该物质与金属钠反应产生 1 mol H2。
写出一种该同分异构体的结构简式:。
(5)根据已有知识并结合题目所给相关信息,写出以CH3OH和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
溴化钙在医药上用作中枢神经抑制药,实验室用“尿素法”制备溴化钙的主要流程如下: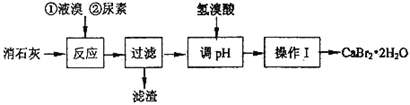
溴化钙的部分溶解度数值如下:
| 温度 |
0℃ |
10℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
| 溶解度(g) |
125 |
132 |
143 |
213 |
278 |
295 |
312 |
(1)6Ca(OH)2+6Br250~70℃5CaBr2+6H2O+Ca(BrO3)2,每生成1 mol Ca(BrO3)2转移电子的物质的量为;50~70℃时,尿素[CO(NH2)2]将生成的Ca(BrO3)2还原为CaBr2,尿素被氧化为N2,该反应的化学方程式为。
(2)过滤所需的玻璃仪器有玻璃棒、,。
(3)加入氢溴酸调pH的作用是。
(4)操作I包括、、过滤、、干燥。
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案。
限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油。