下列关于化学反应限度的说法中正确的是(双选)( )
| A.当一个可逆反应达到平衡状态时,这就是这个反应在该条件下所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,那么这个反应的正向反应速率和逆向反应速率相等 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 |
| D.化学反应的限度不可以通过改变条件而改变 |
运动员服用兴奋剂是违背人文道德的。某种兴奋剂的结构简式如右图所示,有关该物质的说法错误的是()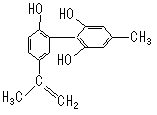
| A.滴入KMnO4(H+)溶液,观察紫色褪去 |
| B.遇FeCl3溶液不显颜色 |
| C.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
| D.该分子中的所有碳原子可能共平面 |
经检验,“毒豆芽”中含有一种动物用药恩诺沙星,其分子结构如下图所示,下列有关恩诺沙星说法不正确的是()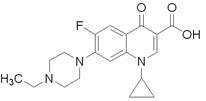
| A.不溶于水,微溶于甲醇,可溶于酸和碱 |
| B.分子式为C19H22FN3O3 |
| C.该物质能发生酯化、加成、氧化、硝化、缩聚反应 |
| D.该物质的一氯代物共有9种 |
某物质的结构简式如图所示,关于该物质的说法正确的是()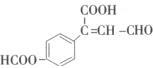
| A.1mol该物质最多能和3mol氢气发生加成反应 |
| B.1mol该物质和银氨溶液反应,最多可生成2mol银 |
| C.1mol该物质最多能和3mol氢氧化钠发生反应 |
| D.1mol该物质和碳酸钠反应可生成1mol二氧化碳 |
结构为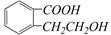 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
①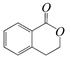 ②
②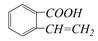 ③
③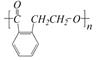 ④
④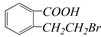 ,
,
生成这四种有机物的反应类型依次为()
| A.取代、消去、酯化、加成 | B.酯化、消去、缩聚、取代 |
| C.酯化、取代、缩聚、取代 | D.取代、消去、加聚、取代 |
以下烃中,一氯代物只有一种的是()
| A.丙烷 | B.正丁烷 | C.正戊烷 | D.新戊烷 |