对于平衡CO2(g)  CO2(aq) ΔH=-19.75 kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
CO2(aq) ΔH=-19.75 kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
| A.升温增压 | B.降温减压 |
| C.升温减压 | D.降温增压 |
碘元素有多种价态,可以形成多种含氧阴离子IxOyn-。由2个IO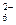 正八面体共用一个面形成的IxOyn-的化学式为
正八面体共用一个面形成的IxOyn-的化学式为
A. |
B. |
C.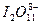 |
D. |
目前人类认为钚(94Pu)是最毒的元素,其一种原子的中子数是质子数的1.596倍。该原子的质量数为
| A.94 | B.150 | C.244.024 | D.244 |
某金属最高价氟化物的相对分子质量为 ,其最高价的硫酸盐的相对分子质量为
,其最高价的硫酸盐的相对分子质量为 ,若此元素的最高正价为n,则n与
,若此元素的最高正价为n,则n与 、
、 的关系可能是( )
的关系可能是( )
A. |
B. |
C. |
D. |
核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中所含质子的物质的量是()
A.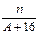 (A-N+8)mol (A-N+8)mol |
B.(A-N+2)mol |
C.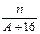 (A-N+10)mol (A-N+10)mol |
D.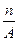 (A-N+6) mol (A-N+6) mol |
“神舟七号”的燃料是氢化锂三兄弟——LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是
A.质子数之比为1::2:3 B.中子数之比为1:1:1
C.摩尔质量之比为8:9:10D.化学性质不相同