将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl2 0.425mol,且溶液中无Fe3+,计算Fe1-xS中的x值(矿石中其他成分不与盐酸反应)。
碳酸氢钠受热易分解为碳酸钠。现加热5.00 g 碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31 g,求①生成CO2多少L(标准状况)? ②原混合物中碳酸钠的质量分数是多少?
将一定量的pH3和H2的混合气体,依次通过两支加热的硬质玻璃管,第一支装有足量的铜屑,第二支装有足量的CuO,第一支玻璃管中因发生反应:2PH3+3Cu Cu3P2+3H2而增重4.96g;第二支玻璃管反应后质量减轻了5.76g;试求:原混合气体中PH3与H2的体积比。
Cu3P2+3H2而增重4.96g;第二支玻璃管反应后质量减轻了5.76g;试求:原混合气体中PH3与H2的体积比。
回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子方程式: 。
②乙同学取336ml(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: 。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
(3)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g。计算放出H2的体积为 升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为 mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml) mol/L
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少?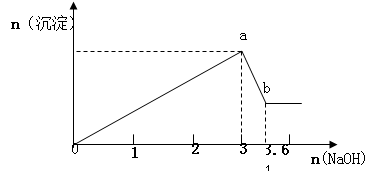
加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。