碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
| |
活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
| 初始 |
2.030 |
0.100 |
0 |
0 |
| 平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题。
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为,K+移向极(填A、B)
。若所盛溶液为KCl溶液:则B极的电极反应式为,K+移向极(填A、B)
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是。
②B电极的电极反应式为。
③U形管内总反应化学方程式是。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是,电极反应式是。B电极的材料应换成是,反应一段时间后电解质溶液中Cu2+浓度(填“增大”、“减小”、“不变”)。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g )+ O2(g) = 2CO2(g)ΔH2=-566.0 kJ/mol
)+ O2(g) = 2CO2(g)ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池负极的电极反应为。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为。
(10分)某无色溶液中含有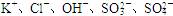 ,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂②~④溶质的化学式分别是:②_________,③_________,④_________,
(2)图中现象a、c表明检验出的离子分别是:a________、c_________
(6分)相对原子质量均大于10的A、B两种元素可化合成X、Y两种气体化合物,1分子X中含A、B原子各1个,1分子Y中含1个A原子和m个B原子。已知7.0 g X在标准状况下的体积约为5.6 L,同温同压下1.0 L Y(g)的质量与22 L氢气的质量相等。通过计算分析X:__________,Y:___________
(12分)下图类似奥运五元环,表示A、B、C、D、E五种化合物,元环交叉部分代表两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料; C能发生反应:化合物(Ⅰ)+化合物(Ⅱ)  化合物(Ⅲ)+化合物(Ⅳ);D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2.
化合物(Ⅲ)+化合物(Ⅳ);D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2.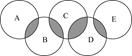
(1) D的化学式为________.
(2)A、B、E中含有一种相同的元素,其在周期表中的位置________.
(3)B和E反应可生成单质G和常见的液态化合物H,写出化学方程式__________________.
(4)写出C符合“化合物(Ⅰ)+化合物(Ⅱ)  化合物(Ⅲ)+化合物(Ⅳ)”的化学方程式________________________________.
化合物(Ⅲ)+化合物(Ⅳ)”的化学方程式________________________________.