下列有关酶的说法中不正确的是 ( )
| A.酶是具有催化作用的蛋白质 |
| B.酶具有选择性和专一性 |
| C.高温或重金属盐能降低酶的活性 |
| D.酶只有在强酸、强碱性条件下才能发挥作用 |
霉酚酸(Mycophenolic acid)是一种生物活性化合物。下列有关霉酚酸的说法不正确的是( )
| A.分子式为:C17H20O6 |
| B.该物质能发生加成、取代、加聚等反应 |
| C.该物质能与FeCl3溶液发生显色反应 |
| D.一定条件下,1 mol霉酚酸最多可与2 mol NaOH反应 |
将足量的BaCO3分别加入:
①30mL水②10mL0.2mol/LNa2CO3溶液
③50m L0.01mol/LBaCl2溶液④100mL0.01mol/LHCl溶液
中溶解至溶液饱和,请确定各溶液中Ba2+的浓度由大到小的顺序为( )
| A.①②③④ | B.③④①② | C.④①③② | D.②①④③ |
已知化学反应A2(g) + B2(g) ="==" 2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收bkJ热量
B. 该反应热△H=+(a-b)kJ/mol
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA—A和1molB—B键,放出akJ能量
下列有关化学方程式的叙述正确的是( )
A.已知2H2(g) + O2(g) ="==" 2H2O(g)△H=-483.6kJ/mol,
则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨, s) ="==" C(金刚石,s)△H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ HCl(aq) ="==" NaCl(aq) + H2O(l)△H="-57.4kJ/mol"
D.已知2C(s)+2O2(g) ===2CO2(g) 2C(s)+ O2(g) ===2CO(g)△H2则△H1>△H2
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是()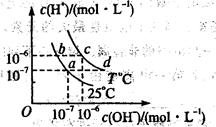
| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42 |
| B.b点对应的溶液中大量存在:NH4+、Ba2+、OH-、I- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO3- |
| D.d点对应的溶液中大量存在:Na+、K+、SO32-、Cl— |