下列根据实验操作和实验现象所得出的结论正确的是 ( )
| 选项 |
操作 |
现象 |
结论 |
| A |
向溶液X中滴加BaCl2溶液,再滴加稀硝酸 |
生成白色沉淀,且不溶解于稀硝酸 |
溶液X中一定含有SO42- |
| B |
向溶液X中滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
溶液X中有I- |
| C |
用洁净铂丝蘸取溶液X进行焰色反应 |
火焰呈黄色 |
溶液X中有Na+,无K+ |
| D |
向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液 |
KMnO4溶液褪色 |
乙烯能使KMnO4溶液褪色 |
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某 种规律的摆放在实验桌上,如下图。某同学取用KNO3溶液后,应把它放回的位置是()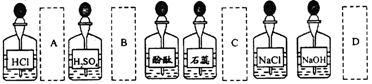
2011年日本核泄漏事故后,我国出现抢盐风潮。2012年年末,四川双流县又出现“连黑三天”的传闻,导致当地蜡烛和火柴脱销,这些事实都说明,具有一定科学素养是多么重要啊。下列关于生活中的化学知识的说法不正确的是()
| A.市售苏打水中添加的实际上是小苏打NaHCO3 |
| B.生活中常用铝壶烧水,这样可以有效补充人体内必需的铝元素 |
| C.84消毒液中含有NaClO,它具有强氧化性和漂白性 |
| D.果汁广告中宣传的维生素C具有抗氧化的功能,实际是指它具有还原性 |
下列变化属于化学变化的是( )
| A.蛋白质盐析 |
| B.碘的升华 |
| C.食盐溶于水 |
| D.碳酸钠晶体风化 |
下图是某有机物分子中C、H、O、N四种原子的成键方式示意图。下列关于该有机物的说法正确的是( )
A.在一定条件下,可以通过聚合反应生成高分子化合物
B.分子式为C3H7NO2
C.不能和盐酸溶液反应
D.不能和NaHCO3溶液反应生成CO2
2004年诺贝尔化学奖授予两名以色列科学家和一名美国科学家。他们突破性地发现人类细胞如何控制某种蛋白质的过程,具体地说,人类细胞对无用蛋白质的“废物处理”就是对其进行降解的过程,也可认为蛋白质发生了( )
| A.酯化反应 | B.水解反应 |
| C.加聚反应 | D.缩聚反应 |