对于3Fe(s)+4H2O(g)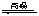 Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为
Fe3O4(s)+4H2(g),若起始投入3mol铁、4mol水汽在体积为0.5L的密闭容器中反应,平衡时氢气的物质的量浓度4mol·L-1,则化学平衡常数为
| A.1/3 | B.1/6.75 | C.1/27 | D.1 |
有些反应看起来不能进行,而实际生产中恰被用来制备带下划线的物质,下列四个反应中,其反应原理与其他三个反应不同的是( )
| A.KClO4+H2SO4===HClO4+KHSO4 |
| B.KCl+NaNO3===NaCl+KNO3 |
| C.Mg+2RbCl===MgCl2+2Rb |
| D.Na+KCl===NaCl+K |
下列化工生产过程中发生的反应不属于氧化还原反应的是( )
| A.用油脂制肥皂 | B.用铝土矿炼金属铝 |
| C.用氯气制漂白粉 | D.用氢气和氮气合成氨 |
下列可被工业上采用的冶金方法是( )
| A.电解熔融的氯化铝制铝 |
| B.电解熔融的氯化镁制镁 |
| C.电解氯化钠溶液制钠 |
| D.高温下用H2还原氧化镁制镁 |
下列关于镁的冶炼说法中,正确的是( )
| A.利用海水和石灰水作用可以得到氯化镁 |
| B.氯化镁的结晶水合物直接受热失去水,得到氯化镁 |
| C.电解氯化镁的水溶液得到金属镁 |
| D.利用氯化镁冶炼金属镁而不利用氧化镁的原因是氧化镁的熔点太高 |
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
| A.不易生锈 | B.导电性好 |
| C.密度小 | D.强度高 |