在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:CO+H2O CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
| A.等于0.6mol | B.等于1mol |
| C.大于0.6mol小于1mol | D.大于1mol |
下列说法正确的是
| A.1H2O与2H2O为两种不同核素 |
| B.3He和4He互为同位素 |
| C.核聚变时,原子核发生了变化,发生了化学反应 |
| D.在3He中存在:质子数=中子数=核外电子数 |
有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)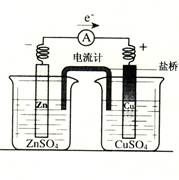
| A.反应中,盐桥中的K+会移向CuSO4溶液 |
| B.取出盐桥后,电流计依然发生偏转 |
| C.铜片上有气泡逸出 |
| D.反应前后铜片质量不改变 |
向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)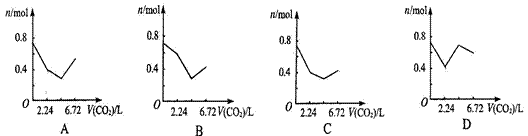
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润红色石蕊试纸变蓝。由该实验能得到的正确结论是
()
| A.原溶液中一定含有SO42-离子 | B.原溶液中一定含有NH4+离子 |
| C.原溶液中一定含有Cl-离子 | D.原溶液中一定含有Fe3+离子 |
在1 LK2SO4和CuSO4的混合溶液中,c(SO42-)=2.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标况)气体,则原溶液中K+的物质的量浓度为()
| A.2.0 mol·L-1 | B.1.5 mol·L-1 |
| C.1.0mol·L-1 | D.0.5 mol·L-1 |