右图所示的石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下Ni可以与CO(g)发生如下反应: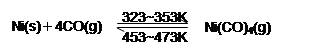
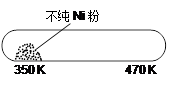
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350 K和470 K,经过足够长时间后,右端的主要物质是
| A.纯Ni(s)和Ni(CO)4(g) | B.纯Ni(s)和CO(g) |
| C.不纯Ni(s)和CO(g) | D.不纯Ni(s)和Ni(CO)4(g) |
将5mol·L-1盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是
| A.0.05mol/L | B.0.25mol/L | C.0.1mol/L | D.0.5mol/L |
等物质的量的 SO2和 SO3相比较,下列结论错误的是
| A.它们的分子数目之比是 1∶1 | B.它们的氧原子数目之比为 2∶3 |
| C.它们的质量之比为 1∶1 | D.它们所含原子数目之比为 3∶4 |
下列叙述正确的是
| A.1molH2O的质量为18g/mol |
| B.CH4的摩尔质量为16g |
| C.3.01×1023个SO2分子的质量为32g |
| D.标准状况下,1mol任何物质体积均为22.4L/mol |
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是
| A.③②①⑤④ | B.①②③⑤④ | C.②③①④⑤ | D.③⑤②①④ |
下列各种仪器:①漏斗;②容量瓶;③滴定管;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是
| A.①③⑦ | B.②⑥⑦ | C.①④⑧ | D.④⑥⑧ |