元素性质呈周期性变化的决定因素是 ( )
| A.元素的原子半径大小呈周期性变化 | B.元素相对原子质量依次递增 |
| C.元素原子的核外电子排布呈周期性变化 | D.元素的主要化合价呈周期性变化 |
下列物质见光不会分解的是()
| A. | B. | C. | D. |
中国科学技术名词审定委员会已确定第116号元素 的名称为鉝。关于 的叙述错误的是
| A. | 原子序数116 | B. | 中子数177 |
| C. | 核外电子数116 | D. | 相对原子质量293 |
室温下向10 0.1 溶的一元酸 溶液 的变化曲线如图所示。下列说法正确的是()
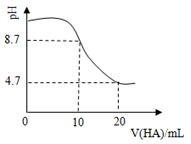
| A. |
点所示溶液中 > > > |
B. |
、 两点所示溶液中水的电离程度相同 |
C. |
=7时, = + |
D. |
点所示溶液中 > |
下列表示对应化学反应的离子方程式正确的是
| A. | 向稀 中滴加 溶液: |
| B. | 向 溶液中通入过量 : |
| C. | 向 溶液中加入过量的 : |
| D. | 向 溶液中加入 : |
下列由实验现象得出的结论正确的是
| 操作及现象 |
结论 |
|
| A |
向
悬浊液中加入
溶液时出现黄色沉淀。 |
< |
| B |
向某溶液中滴加氯水后再加入
溶液,溶液呈红色。 |
溶液中一定含有 |
| C |
向
溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。 |
还原性强于 |
| D |
加热盛有
固体的试管,试管底部固体消失,试管口有晶体凝结。 |
固体可以升华 |